 |
Chlor Pool Schwimmbad ionisation brom ionizer algizid silber kupfer elekrolyse ionizador gebundenes freies desinfektion spa jakusi reinigung pumpe oxidieren oxidation ph wasser chloramin gesamtchlor hygiene reinigung chloride filter legionellen trihalogen thm chlorgas pH ozon säure saeure cyanur redox spannung methan ventil wellnes dusche whirlwanne whirlpool jakuzi jakuzzi freibad |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ohne den pH-Wert im Bereich von 7,1 bis 7,4 , funktioniert kein Schwimmbad richtig! Der
ideale pH-Wert für eine erfolgreiche
Schwimmbadwasserpflege liegt zwischen 7,0 und 7,4. Dieser Bereich wird
dem
Wohlbefinden der Badenden, der Lebensdauer von Schwimmbadmaterialien
und der
optimalen Wirkung der Wasserpflegemittel, z. B. Ionisation,
gleichermaßen gerecht. Will man
unerwünschte Auswirkungen vermeiden, sollte der pH-Wert mindestens
alle 8 Tage
geprüft und auf 7,0 bis 7,4 eingestellt werden. Ein zu niedriger
pH-Wert 0 bis
7,0 führt zu Korrosionen an Metallteilen. Das Wasser reagiert
sauer. Höhere
pH-Werte über 7,6 vermindern die Wirksamkeit jeglicher
Poolpflegemittel und das
Wasser ist aggressiv gegenüber der Haut und der gesamten
Poolinstalation. 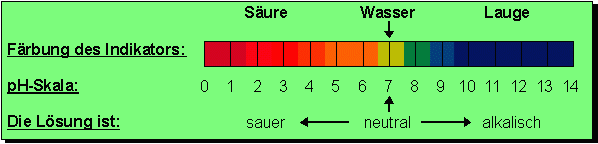 Der Ausgangspunkt der Skala ist neutrales Wasser, welches immer einen pH-Wert von 7 besitzt. Werte unterhalb von 7 zeigen Säuren an, Werte oberhalb von 7 Laugen. Je kleiner der pH-Wert, um so stärker ist die vorhandene Säure. Die Skala ist so abgestuft, dass pro Wert die Säurestärke um den Faktor 10 zunimmt. Eine Säure mit dem pH-Wert 3 ist zehnmal so stark als eine Säure mit dem pH-Wert 4!
Erweiterte Definition für Fortgeschrittene: Der pH-Wert ist genau genommen eine Maßzahl, die angibt, wie hoch die Konzentration an H3O+-Ionen [H3O+] in einer wässrigen Lösung ist. Sie wird durch den negativ dekadischen Logarithmus der H3O+-Ionen-Konzentration ausgedrückt: pH = - log [H3O+] Beispiel: In reinem Wasser befinden sich immer 10-7 mol/l an H3O+-Ionen (und auch an OH--Ionen). Dies ergibt sich aus dem Ionenprodukt des Wassers. Wasser selbst wirkt also immer in geringem Umfang als Säure (oder als Base). Diese Eigenschaft wird als Autoprotolyse des Wassers bezeichnet. Nun wird die Säure Konzentration der H3O+-Ionen im Wasser in die Gleichung zur Berechnung des pH-Werts eingesetzt: pH = - log [10-7] = -(-7) = 7 Dadurch ergibt sich ein pH-Wert von 7 für Wasser. Der pOH-Wert gibt die Konzentration an OH--Ionen im Wasser an. Für alle Säuren und Laugen lässt sich demnach immer ein pH-Wert und ein pOH-Wert berechnen. Die Summe der beiden Werte ergibt immer 14: pH + pOH = 14 Die folgenden Tabelle zeigt die Beziehung zwischen dem pH-Wert und dem pOH-Wert in Abhängigkeit von der vorliegenden Konzenatration:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||